Quá trình chuyển đổi đoạn nhiệt giữa hai trạng thái trong chất khí không phải là một trong những quá trình đẳng áp, tuy nhiên, nó đóng một vai trò quan trọng không chỉ trong các quá trình công nghệ khác nhau mà còn trong tự nhiên. Trong bài viết này, chúng ta sẽ xem xét quá trình này là gì và cũng đưa ra các phương trình đoạn nhiệt cho một khí lý tưởng.
Khí lý tưởng trong ngắn hạn
Khí lý tưởng là khí không có tương tác giữa các hạt của nó và kích thước của chúng bằng không. Tất nhiên, trong tự nhiên, không có một trăm phần trăm khí lý tưởng, vì chúng đều được cấu tạo từ các phân tử và nguyên tử có kích thước, luôn tương tác với nhau ít nhất là với sự trợ giúp của lực van der Waals. Tuy nhiên, mô hình được mô tả thường được thực hiện với độ chính xác đủ để giải quyết các vấn đề thực tế đối với nhiều loại khí thực.
Phương trình chính của khí lý tưởng là định luật Clapeyron-Mendeleev. Nó được viết ở dạng sau:
PV=nRT.
Phương trình này thiết lập tỷ lệ thuận giữa sản phẩmáp suất P ở thể tích V và lượng chất n ở nhiệt độ tuyệt đối T. Giá trị của R là hằng số chất khí, đóng vai trò là hệ số tỉ lệ.
Quy trình đoạn nhiệt là gì?
Quá trình đoạn nhiệt là sự chuyển đổi giữa các trạng thái của một hệ khí trong đó không có sự trao đổi năng lượng với môi trường. Trong trường hợp này, cả ba đặc tính nhiệt động của hệ (P, V, T) đều thay đổi và lượng chất n không đổi.
Phân biệt giữa giãn nở đoạn nhiệt và co lại. Cả hai quá trình chỉ xảy ra do năng lượng bên trong của hệ thống. Vì vậy, do sự giãn nở, áp suất và đặc biệt là nhiệt độ của hệ thống giảm đột ngột. Ngược lại, nén đoạn nhiệt dẫn đến một bước nhảy tích cực về nhiệt độ và áp suất.
Để ngăn cản sự trao đổi nhiệt giữa môi trường và hệ thống, hệ thống sau phải có tường cách nhiệt. Ngoài ra, việc rút ngắn thời gian quy trình làm giảm đáng kể dòng nhiệt đến và đi trong hệ thống.
Phương trình Poisson cho quá trình đoạn nhiệt

Định luật đầu tiên của nhiệt động lực học được viết như sau:
Q=ΔU + A.
Nói cách khác, nhiệt lượng Q truyền cho hệ được sử dụng để thực hiện công A của hệ và để tăng nội năng ΔU của nó. Để viết phương trình đoạn nhiệt, ta nên đặt Q=0, tương ứng với định nghĩa của quá trình đang nghiên cứu. Chúng tôi nhận được:
ΔU=-A.
Với isochoricquá trình trong một chất khí lý tưởng, nhiệt lượng tỏa ra làm tăng nội năng. Thực tế này cho phép chúng ta viết đẳng thức:
ΔU=CV ΔT.
Trong đó CVlà nhiệt dung đẳng tích. Công việc A, lần lượt, được tính như sau:
A=PdV.
Trong đó dV là sự thay đổi âm lượng nhỏ.
Ngoài phương trình Clapeyron-Mendeleev, phương trình sau đây phù hợp với khí lý tưởng:
CP- CV=R.
Trong đó CPlà nhiệt dung đẳng tích, luôn lớn hơn nhiệt đẳng tích, vì nó có tính đến tổn thất khí do giãn nở.
Phân tích các phương trình được viết ở trên và tích phân theo nhiệt độ và thể tích, chúng ta đi đến phương trình đoạn nhiệt sau:
TVγ-1=const.
Đây γ là chỉ số đoạn nhiệt. Nó bằng tỉ số giữa nhiệt dung đẳng tích và đẳng tích. Đẳng thức này được gọi là phương trình Poisson cho một quá trình đoạn nhiệt. Áp dụng định luật Clapeyron-Mendeleev, bạn có thể viết thêm hai biểu thức tương tự, chỉ thông qua các tham số P-T và P-V:
TPγ / (γ-1)=const;
PVγ=const.
Đồ thị đoạn nhiệt có thể được đưa ra theo các trục khác nhau. Dưới đây nó được hiển thị theo trục P-V.
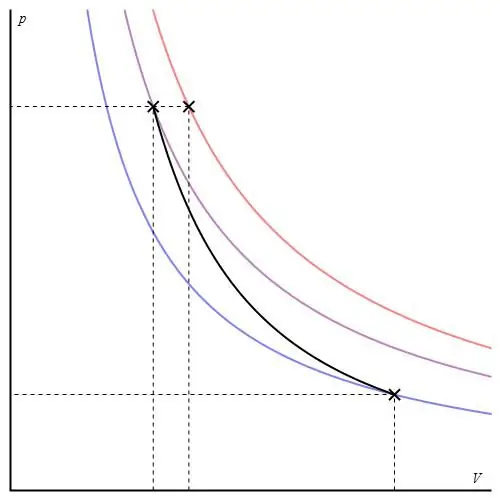
Các đường màu trên biểu đồ tương ứng với các đường đẳng nhiệt, đường cong màu đen là một đoạn nhiệt. Có thể thấy, đoạn nhiệt hoạt động mạnh hơn bất kỳ đường đẳng nhiệt nào. Thực tế này rất dễ giải thích: đối với đường đẳng nhiệt, áp suất thay đổi ngược lạitỷ lệ thuận với thể tích, nhưng đối với đường đẳng áp, áp suất thay đổi nhanh hơn, vì số mũ là γ>1 đối với bất kỳ hệ thống khí nào.
Bài toán ví dụ
Trong tự nhiên, ở vùng núi, khi khối khí di chuyển lên dốc, áp suất giảm, thể tích tăng lên và lạnh đi. Quá trình đoạn nhiệt này làm giảm điểm sương và tạo ra kết tủa lỏng và rắn.

Người ta đề xuất giải một bài toán sau: trong quá trình nâng khối khí dọc theo sườn núi, áp suất giảm 30% so với áp suất dưới chân. Nhiệt độ của nó bằng bao nhiêu nếu ở chân nó là 25oC?
Để giải quyết vấn đề, hãy sử dụng phương trình đoạn nhiệt sau:
TPγ / (γ-1)=const.
Tốt hơn là viết nó ở dạng này:
T2/ T1=(P2/ P1)(γ-1) / γ.
Nếu P1được coi là 1 bầu khí quyển, thì P2sẽ bằng 0,7 atm. Đối với không khí, chỉ số đoạn nhiệt là 1,4, vì nó có thể được coi là khí lý tưởng tảo cát. Giá trị nhiệt độ của T1là 298,15 K. Thay tất cả các số này vào biểu thức trên, ta được T2=269,26 K, tương ứng với - 3, 9oC.






