Trong thời đại của chúng ta, vật lý đã trở thành một môn khoa học rất phổ biến. Theo nghĩa đen, nó hiện diện ở khắp mọi nơi. Ví dụ cơ bản nhất: một cây táo mọc trong sân nhà bạn, và quả chín trên đó, đến lúc và quả táo bắt đầu rụng, nhưng chúng sẽ rơi theo hướng nào? Nhờ định luật vạn vật hấp dẫn, thai nhi của chúng ta rơi xuống đất, tức là đi xuống, nhưng không lên. Đó là một trong những ví dụ nổi tiếng nhất của vật lý, nhưng chúng ta hãy chú ý đến nhiệt động lực học, hay chính xác hơn là cân bằng pha, thứ không kém phần quan trọng trong cuộc sống của chúng ta.
Nhiệt động lực học

Trước hết, chúng ta hãy xem thuật ngữ này. ΘερΜοδυναΜική - đây là cách nhìn của từ này trong tiếng Hy Lạp. Phần đầu tiên ΘερΜo có nghĩa là "ấm áp", và δυναΜική thứ hai có nghĩa là "sức mạnh". Nhiệt động lực học là một nhánh của vật lý nghiên cứu các đặc tính của một hệ vĩ mô, cũng như các cách chuyển đổi và truyền năng lượng khác nhau. Trong phần này, các trạng thái và quá trình khác nhau được nghiên cứu đặc biệt để khái niệm nhiệt độ có thể được đưa vào mô tả (đây là đại lượng vật lý đặc trưng cho hệ nhiệt động lực học và được đo bằng cách sử dụngthiết bị nhất định). Tất cả các quá trình đang diễn ra trong hệ thống nhiệt động lực học chỉ được mô tả bằng các đại lượng hiển vi (áp suất và nhiệt độ, cũng như nồng độ của các thành phần).
Phương trình Clapeyron-Clausius
Mọi nhà vật lý đều biết phương trình này, nhưng hãy chia nhỏ nó ra từng phần một. Nó đề cập đến các quá trình cân bằng của sự chuyển đổi của một số vật chất từ giai đoạn này sang giai đoạn khác. Điều này được thấy rõ trong các ví dụ như: nóng chảy, bay hơi, thăng hoa (một trong những cách bảo quản sản phẩm, diễn ra bằng cách loại bỏ hoàn toàn độ ẩm). Công thức hiển thị rõ ràng các quá trình đang diễn ra:
- n=PV / RT;
- trong đó T là nhiệt độ của chất;
- P-áp suất;
- nhiệt riêng R của quá trình chuyển pha;
- V-thay đổi trong âm lượng cụ thể.
Lịch sử hình thành phương trình

Phương trình Clausius-Clapeyron là một giải thích toán học xuất sắc về định luật thứ hai của nhiệt động lực học. Còn được gọi là "bất đẳng thức Clausius". Đương nhiên, định lý được phát triển bởi chính nhà khoa học, người muốn giải thích mối quan hệ giữa dòng nhiệt trong hệ và entropi, cũng như môi trường của nó. Phương trình này được Clausius phát triển trong nỗ lực giải thích và định lượng entropi của ông. Theo nghĩa đen, định lý cho chúng ta cơ hội để xác định xem một quá trình tuần hoàn là thuận nghịch hay không thể đảo ngược. Bất đẳng thức này cung cấp cho chúng ta một công thức định lượng để hiểu định luật thứ hai.
Nhà khoa học là một trong những người đầu tiên nghiên cứu ý tưởng về entropy, và thậm chí đã đưa ratên quy trình. Cái mà ngày nay được gọi là định lý Clausius được xuất bản lần đầu tiên vào năm 1862 trong công trình thứ sáu của Rudolf, Về việc sử dụng định lý tương đương chuyển đổi cho công việc nội thất. Nhà khoa học đã cố gắng chỉ ra mối quan hệ tỷ lệ giữa entropi và dòng năng lượng bằng cách đốt nóng (δ Q) trong hệ thống. Trong xây dựng, nhiệt năng này có thể được chuyển hóa thành công, và nó có thể được chuyển hóa thành nhiệt thông qua một quá trình tuần hoàn. Rudolph đã chứng minh rằng "tổng đại số của tất cả các phép biến đổi xảy ra trong một quá trình tuần hoàn chỉ có thể nhỏ hơn 0 hoặc trong trường hợp cực đoan là bằng không."
Hệ thống cách ly khép kín
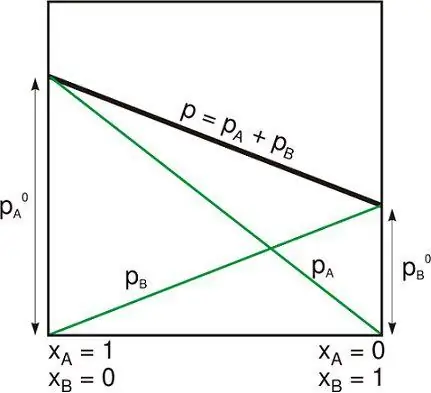
Hệ thống biệt lập là một trong những hệ thống sau:
- Hệ thống vật lý khác xa với những hệ thống khác không tương tác với chúng.
- Hệ thống nhiệt động lực học được đóng bởi những bức tường cố định cứng mà không vật chất và năng lượng nào có thể đi qua.
Mặc dù thực tế là đối tượng có liên quan nội tại với lực hấp dẫn của chính nó, nhưng một hệ thống cô lập thường được đưa ra ngoài giới hạn của lực hấp dẫn bên ngoài và các lực ở xa khác.
Điều này có thể trái ngược với điều (trong thuật ngữ chung hơn được sử dụng trong nhiệt động lực học) được gọi là một hệ thống kín được bao quanh bởi các bức tường chọn lọc, qua đó năng lượng có thể được truyền dưới dạng nhiệt hoặc công, nhưng không phải vật chất. Và với một hệ thống mở, trong đó vật chất và năng lượng đi vào hoặc đi ra, mặc dù nó có thể có nhiều bức tường không thể xuyên thủng khác nhau trongcác phần của biên giới của nó.
Một hệ cô lập tuân theo định luật bảo toàn. Thông thường, trong nhiệt động lực học, vật chất và năng lượng được coi là những khái niệm riêng biệt.
Chuyển đổi nhiệt động lực học
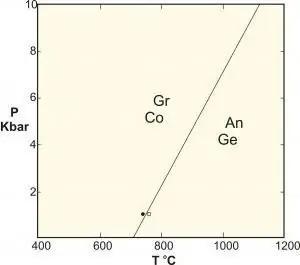
Để hiểu các chuyển đổi pha lượng tử, sẽ rất hữu ích nếu so sánh chúng với các phép biến đổi cổ điển (còn gọi là các phép nghịch chuyển nhiệt). CPT mô tả điểm đỉnh trong các đặc tính nhiệt động lực học của một hệ thống. Nó báo hiệu sự tái tổ chức của các hạt. Một ví dụ điển hình là quá trình chuyển đổi đóng băng của nước, mô tả sự chuyển đổi trơn tru giữa chất lỏng và chất rắn. Tăng trưởng pha cổ điển là do sự cạnh tranh giữa năng lượng của hệ thống và entropi của các dao động nhiệt của nó.
Một hệ thống cổ điển không có entropi ở nhiệt độ 0 và do đó không thể xảy ra sự biến đổi pha. Bậc của chúng được xác định bởi thế nhiệt động đạo hàm không liên tục bậc nhất. Và, tất nhiên, nó có đơn đặt hàng đầu tiên. Sự biến đổi pha từ sắt từ sang paramagnet là liên tục và bậc hai. Những thay đổi liên tục này từ một giai đoạn có thứ tự sang một giai đoạn có trật tự được mô tả bằng một tham số thứ tự bằng không. Đối với sự biến đổi sắt từ ở trên, tham số thứ tự sẽ là tổng từ hóa của hệ thống.
Gibbs tiềm năng
Năng lượng miễn phí Gibbs là lượng công việc tối đa không giãn nở có thể được loại bỏ khỏi một hệ thống kín nhiệt động lực học (có thể trao đổi nhiệt và hoạt động với môi trường). Như làkết quả tối đa chỉ có thể đạt được trong một quá trình hoàn toàn thuận nghịch. Khi hệ thống chuyển đổi ngược lại từ trạng thái đầu tiên sang trạng thái thứ hai, sự giảm năng lượng tự do Gibbs bằng năng lượng do hệ thực hiện trong môi trường của nó, trừ đi công của các lực áp suất.
Kỳ dư

Cân bằng nhiệt động và cơ học là một khái niệm tiên đề của nhiệt động lực học. Đây là trạng thái bên trong của một hoặc nhiều hệ thống được kết nối bởi nhiều hoặc ít tường thấm hoặc không thấm. Ở trạng thái này, không có dòng vật chất hay năng lượng thuần túy vĩ mô nào, trong một hệ thống hoặc giữa các hệ thống.
Theo quan niệm riêng của nó về trạng thái cân bằng bên trong, sự thay đổi vĩ mô không xảy ra. Các hệ thống đồng thời ở trạng thái cân bằng nhiệt, cơ học, hóa học (không đổi), bức xạ tương hỗ. Chúng có thể ở cùng một dạng. Trong quá trình này, tất cả các khung nhìn được lưu cùng một lúc và vô thời hạn cho đến khi hoạt động vật lý bị hỏng. Trong trạng thái cân bằng vĩ mô, các trao đổi cân bằng hoàn toàn chính xác diễn ra. Bằng chứng trên là một giải thích vật lý cho khái niệm này.
Khái niệm cơ bản
Mỗi định luật, định lý, công thức đều có nền tảng riêng. Hãy xem 3 cơ sở của quy luật cân bằng pha.
- Pha là một dạng vật chất, đồng nhất về thành phần hóa học, trạng thái vật lý và cân bằng cơ học. Các pha điển hình là rắn, lỏng và khí. Hai chất lỏng không thể trộn lẫn (hoặc hỗn hợp chất lỏng có các thành phần khác nhau) được phân tách bởi một ranh giới riêng biệt được coi là hai pha riêng biệt và chất rắn không thể trộn lẫn.
- Số thành phần (C) là số thành phần độc lập về mặt hóa học của hệ thống. Số lượng loài độc lập tối thiểu cần thiết để xác định thành phần của tất cả các giai đoạn của hệ thống.
- Số bậc tự do (F) trong ngữ cảnh này là số lượng các biến chuyên sâu độc lập với nhau.
Phân loại theo pha cân bằng
- Phản ứng chuyển tịnh liên tục (thường gọi là phản ứng ở trạng thái rắn) xảy ra giữa các chất rắn có thành phần cấu tạo khác nhau. Chúng có thể bao gồm các nguyên tố được tìm thấy trong chất lỏng (H, C), nhưng các nguyên tố này được giữ lại trong pha rắn, vì vậy không có pha lỏng nào tham gia làm chất phản ứng hoặc sản phẩm (H2O, CO 2 ). Các phản ứng chuyển nguyên chất rắn có thể liên tục hoặc không liên tục, hoặc kết thúc.
- Đa thể là một dạng phản ứng đặc biệt ở pha rắn bao gồm các pha có thành phần giống hệt nhau. Các ví dụ cổ điển là phản ứng giữa nhôm silicat kyanite-sillimanite-andalusite, sự chuyển đổi graphit thành kim cương ở áp suất cao và cân bằng của canxi cacbonat.
Quy luật cân bằng

Quy tắc Nhà máy Gibbs được đề xuất bởi Josiah Willard Gibbs trong bài báo nổi tiếng của ông có tiêu đề "Sự cân bằng của các chất không đồng nhất", xuất hiện từ năm 1875 đến năm 1878. Nó áp dụng chocác hệ dị thể đa thành phần không phản ứng ở trạng thái cân bằng nhiệt động lực học và là một đẳng thức đã cho:
- F=C-P + 2;
- trong đó F là số bậc tự do;
- C - số lượng thành phần;
- P - số pha ở trạng thái cân bằng nhiệt động với nhau.
Số bậc tự do là số lượng các biến chuyên sâu chưa được sử dụng. Số lượng lớn nhất của các thông số nhiệt động lực học, chẳng hạn như nhiệt độ hoặc áp suất, có thể thay đổi đồng thời và tùy ý mà không ảnh hưởng đến nhau. Ví dụ về hệ thống một thành phần là hệ thống có một hóa chất tinh khiết duy nhất, trong khi hệ thống hai thành phần, chẳng hạn như hỗn hợp nước và etanol, có hai thành phần độc lập. Sự chuyển pha điển hình (cân bằng pha) là chất rắn, chất lỏng, chất khí.
Quy tắc pha ở áp suất không đổi
Đối với các ứng dụng trong khoa học vật liệu xử lý sự thay đổi pha giữa các cấu trúc rắn khác nhau, áp suất không đổi thường xảy ra (ví dụ: một bầu khí quyển) và bị bỏ qua như một bậc tự do, vì vậy quy tắc trở thành: F=C - P + 1.
Công thức này đôi khi được giới thiệu dưới tên "quy tắc pha đặc", nhưng như chúng ta đã biết, nó không thể áp dụng cho các hệ thống chịu áp suất cao (ví dụ: trong địa chất), vì hậu quả của những áp lực có thể gây ra hậu quả thảm khốc.
Có vẻ như cân bằng pha chỉ là một cụm từ trống rỗng, và có rất ít quá trình vật lý diễn ra thời điểm nàycó liên quan, nhưng, như chúng ta đã thấy, nếu không có nó, nhiều luật chúng ta biết không hoạt động, vì vậy bạn cần làm quen một chút với những quy tắc độc đáo, đầy màu sắc, mặc dù hơi nhàm chán này. Những kiến thức này đã giúp ích cho rất nhiều người. Họ đã học cách áp dụng chúng cho chính mình, chẳng hạn như thợ điện, biết các quy tắc làm việc với các giai đoạn, có thể tự bảo vệ mình khỏi nguy hiểm không đáng có.






